Prêmio de liderança dos Emirados Árabes

Os líderes dos Emirados Árabes Unidos são talentosos Donald Trump A maior honra civil de seu país na quinta -feira.
“Reconhecer os excelentes esforços do presidente Donald Trump para fortalecer os laços de longo prazo em amizades e parcerias estratégicas Emirados Árabes Unidos E os Estados Unidos da América, tenho a honra de anunciar que sua Alteza Sheikh Mohammed bin Zayed Al Nahyan concedeu ao presidente Trump a Ordem Zayed: “Antes de Trump receber esse prêmio, uma mulher foi ouvida.
O Ministério das Relações Exteriores dos Emirados Árabes Unidos disse: “A ordem de Zayed é considerada a maior honra civil concedida pelos Emirados Árabes Unidos e foi concedida aos líderes mundiais e chefes de Estado”.
O ministério acrescentou: “O prêmio recebeu o nome do pai fundador dos Emirados Árabes Unidos, o falecido xeque Zayed, cujo legado do humanitarismo, cooperação internacional e a busca da paz continuam a ter um impacto em todo o mundo hoje”.
Trump visita os Emirados Árabes Unidos como o primeiro presidente dos EUA em quase 20 anos
A ordem Zayed do presidente Donald Trump em Abu Dhabi, Emirados Árabes Unidos, realizada na quinta -feira, 15 de maio em Abu Dhabi, Emirados Árabes Unidos. (AP/Alex Brandon)
Trump chegou aos Emirados Árabes Unidos na quinta -feira e finalmente parou nesta semana em uma viagem ao Oriente Médio, a primeira vez que o presidente dos EUA viajou em todo o país em quase 20 anos após sua viagem de George W. Bush em 2008.
Trump e Catar Leg em defesa e compras da Boeing
Em março, os Emirados Árabes Unidos promete US $ 1,4 trilhão em investimento Na economia dos EUA na próxima década, os programas de infraestrutura de IA, semicondutores, energia e fabricação dos EUA incluem um programa que quase dobrará a produção de alumínio dos EUA investindo em novas fundições pela primeira vez em 35 anos.
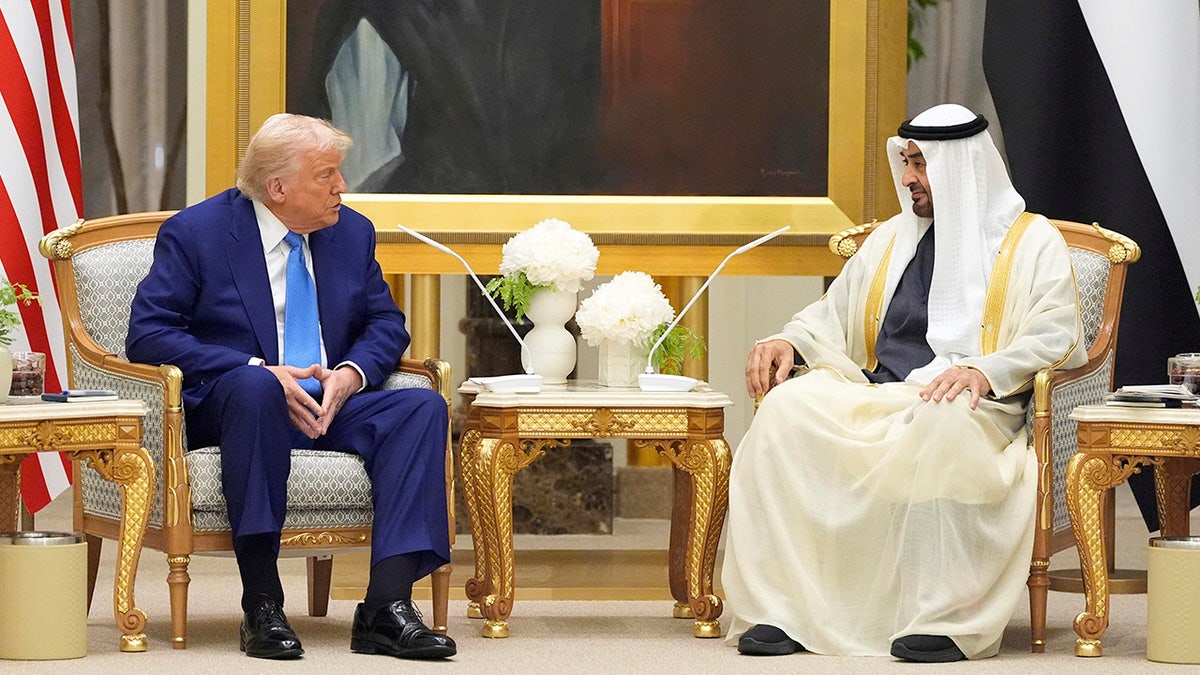
O presidente Donald Trump e o presidente dos Emirados Árabes Unidos, Mohammed Bin Zayed Al Nahyan, falaram na quinta -feira, 15 de maio. (AP/Alex Brandon)
Clique aqui para obter o aplicativo Fox News
Na véspera da visita do presidente ao Oriente Médio, o Departamento de Estado também anunciou a venda de US $ 1,4 bilhão em helicópteros CH-47 F Chinook e peças de caça F-16 para Abu Dhabi.
Caitlin McFall, da Fox News, contribuiu para o relatório.




